Faktencheck: Wie steht es um Klinische Prüfungen in Österreich?

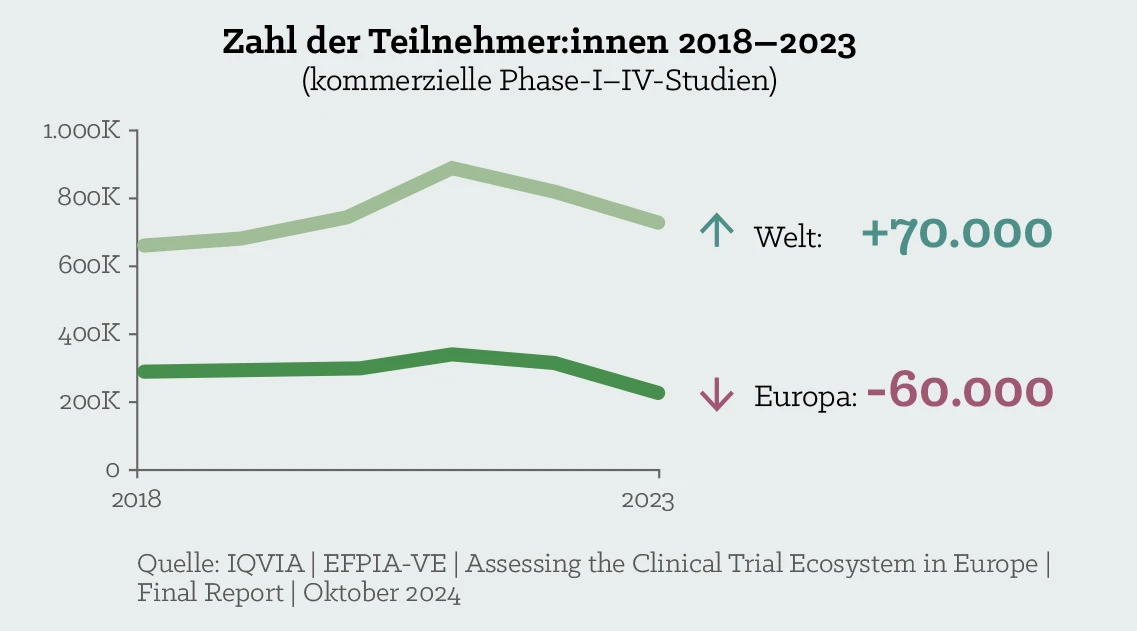
Zwischen 2013 und 2023 ist der Anteil der von der Industrie gesponserten klinischen Forschungsprojekte im Europäischen Wirtschaftsraum (EWR) von 22 % auf 12 % gesunken.
Dadurch konnten rund 60.000 Patient:innen nicht mehr von einem frühzeitigen Zugang zu innovativen Therapien profitieren, weil es für sie keine entsprechenden klinischen Prüfungen mehr gab, an denen sie hätten teilnehmen können. Auch in Österreich ist ein deutlicher Rückgang bei den Erstanträgen zu verzeichnen.
Pharmazeutische Unternehmen achten heute stärker auf Standortbedingungen denn je: Entscheidend sind rasche Verfahren zum Studienstart, vorhandene Infrastruktur, potenzielle Anzahl an Studienteilnehmenden oder auch wie schnell die neu entwickelten Therapien im jeweiligen Land auf den Markt gebracht werden können.
Europa verliert Patient:innen in klinischen Studien
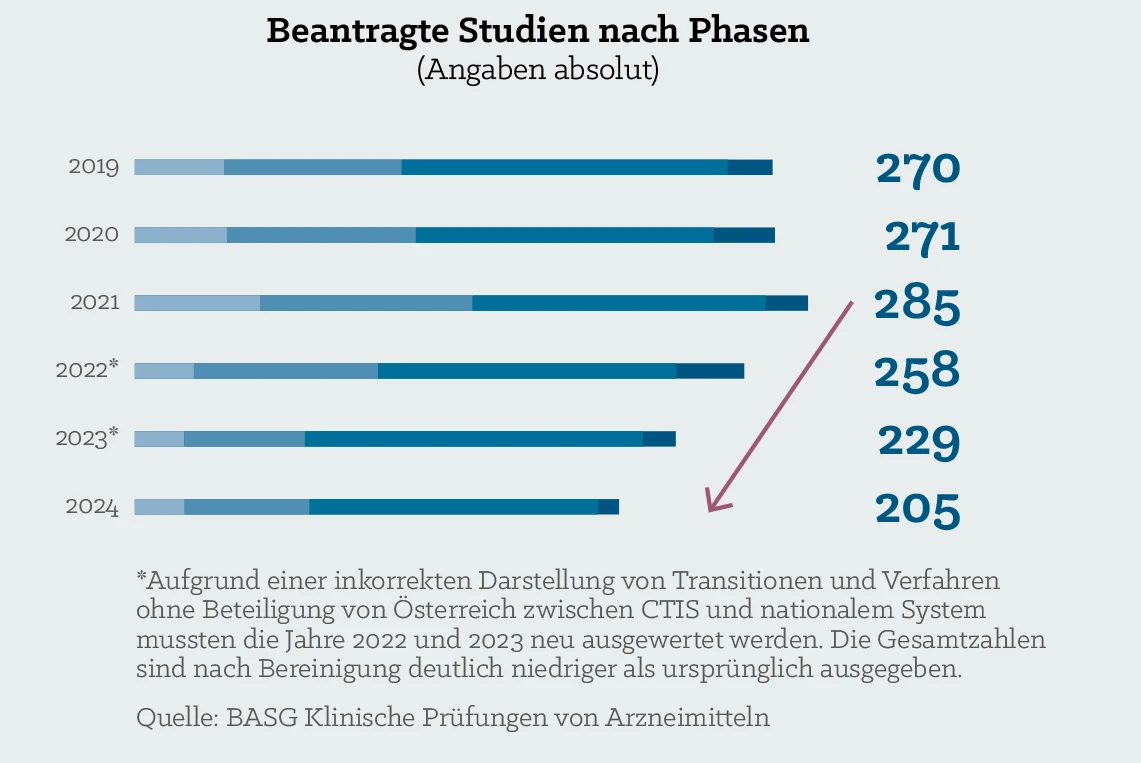
Klinische Prüfungen in Österreich 2019 - 2024
Grundsätzlich gilt: Ein Medikament wird dort schneller verfügbar, wo es entwickelt wurde. Europa hat hier an Attraktivität verloren – durch komplexe Vorgaben, ein schwieriges Finanzierungsumfeld und langsamere Abläufe etwa im Vergleich zu den USA.
Damit Patient:innen und das Gesundheitssystem schneller von Innovationen profitieren, sind moderne Infrastruktur, mehr Fachpersonal, digitale Lösungen und effizientere Genehmigungen nötig. Ziel muss es dabei sein, klinische Prüfungen in Österreich schneller und effizienter genehmigt zu bekommen, und zwar bei gleichbleibend hoher Sicherheit für die Teilnehmenden.
Ursachen für den Rückgang
- gestiegene regulatorische Anforderungen seit Inkrafttreten der
EU-Verordnung über klinische Prüfungen (CTR EU 536/2014)
im Jahr 2022 - langwierige Prozesse bei Machbarkeitsprüfungen und Verträgen
- mangelnde Vernetzung zwischen Studienzentren
- zu wenig speziell der klinischen Forschung gewidmetes Personal
- hoher administrativer Aufwand
Österreich reagiert:
Beschleunigtes Verfahren für klinische Prüfungen, die beim Erstantrag als mononational in Österreich eingereicht werden
Seit 22. April 2025 gilt in Österreich eine wichtige Neuerung: Wird eine Studie beim Erstantrag ausschließlich in Österreich durchgeführt („mononational“), entfallen Koordinierungs- und Abstimmungsprozesse mit anderen EU-Ländern. Die Fristen im Genehmigungsverfahren verkürzen sich deutlich von 65 auf 30 Tage. Nach der Genehmigung ist eine Ausweitung auf weitere Länder möglich.
Das Ergebnis
Patient:innen, Forscher:innen und Unternehmen profitieren von beschleunigten Verfahren. Österreich wird damit als Forschungsstandort attraktiver.
Weitere Standortvorteile bei Erstanträgen in Österreich
- Übersichtliche Strukturen: Ethische Bewertung durch fünf gut abgestimmte Ethikkommissionen; weitere Informationen: https://austrianethics.at/ctr
- Klare Vorgaben: Nationale Anforderungen sind übersichtlich und verständlich auf den Websites des BASG sowie der Plattform der CTR Ethikkommissionen online abrufbar
- Einheitliche Vorlagen: abgestimmtes Template der Teilnehmer:innen-Information und Einverständniserklärung
- Direkte Kommunikation: Enge Zusammenarbeit zwischen Behörde, Ethikkommissionen und Antragstellenden
